DNA çipleri. Supramoleküler nanobaskı. Tıpta ve genetikte kullanımları
Üretim teknolojisi ve tasarımı, biyolojik mikroçiplerin avantaj ve dezavantajlarının, uygulamalarının, fiyat özelliklerinin ve genel bulunabilirliğinin ana belirleyicileridir.
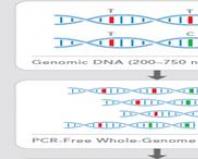
DNA çiplerinin üretimine yönelik temelde iki farklı yaklaşım vardır: belirli bir sekansın DNA'sının doğrudan bir matris üzerinde sentezi ve önceden sentezlenmiş oligonükleotitlerin bir substrat üzerinde kimyasal olarak immobilizasyonu. Fotolitografi yoluyla bir substrat üzerinde oligonükleotidlerin sentezlenmesi teknolojisi patentlidir ve DNA çipleri üretiminde dünya lideri olan ve küresel pazarın %70'ini kontrol eden Affymetrix tarafından kullanılmaktadır. Teknoloji, monomerik DNA birimleri için, UV ışığı ile ışınlama üzerine substrat üzerinde sentezlenen oligonükleotidin terminal kalıntısından uzaklaştırılan, foto-labil bir koruyucu grubun kullanımına dayanmaktadır. Bu teknolojinin avantajı, 1 cm2 başına 100.000 noktaya kadar çok yüksek birikme yoğunluğuna sahip talaşlar üretme olanağıdır. Yöntemin bariz dezavantajı, sürecin karmaşıklığı ve yüksek maliyetidir.
DNA fragmanlarının katı substratlar üzerinde kimyasal immobilizasyonuna yönelik teknolojiler yaklaşık 30 yıl önce geliştirilmeye başlandı ve şu anda geliştirilmeye devam ediyor. Biyolojik moleküllerin immobilizasyonunun genel prensibi, substratın yüzeyinde ve dikilmiş oligonükleotidin ucunda bir çift kimyasal grubun oluşması ve aralarında kovalent bir bağ oluşmasının sağlanmasıdır. Çoğu, bir substratın yüzeyinde bulunan veya bir oligonükleotid molekülüne bağlı bir nükleofilik grubun (örneğin bir amino grubu), bir elektrofilik madde ile etkileşimine dayanan çok sayıda bu tür yöntem vardır. karboksilik asitler, fosforik asit monoesterleri vb. ile bir şekilde aktive edilebilir.
DNA mikrodizileri kullanılarak gen ifadesinin değerlendirilmesi ( Affymetrix GeneChip örneğini kullanarak)
DNA mikrodizilerinin en yaygın kullanımı gen ifadesinin değerlendirilmesidir. Bu sınıftaki sorunları çözmek için en popüler platform, bir RNA örneğinde bulunan genleri tanımlamak için kısa oligonükleotid dizileri kullanan Affymetrix GeneChip mikrodizileridir. Numunedeki her genin varlığı, her biri 25 nükleotid uzunluğundaki bir dizi prob kullanılarak tespit edilir. Deneyin kalitesini artırmak için, incelenen her dizi için çipin üzerine birkaç prob kopyası yerleştirilir.
Affymetrix mikrodizileri tipik olarak ilgilenilen gen başına 11 ila 20 örnek çifti kullanır. Bu tür çiftlerin mükemmel uyum probu (PM) olarak adlandırılan bir bileşeni, karşılık gelen genin dizisine tam olarak tamamlayıcıdır - PM probuna bağlanacak olanın onun RNA'sı olduğu anlaşılmaktadır. Bu birleşmeye spesifik hibridizasyon denir. Ancak diğer genlerin nükleotid dizileri problara eklenebilir (spesifik olmayan hibridizasyon). Spesifik olmayan hibridizasyonun etkisini değerlendirmek için çiftin diğer bileşenleri kullanılır - uyumsuzluk probu (MM) adı verilen problar. İçlerindeki nükleotid dizisi, merkezi (on üçüncü) nükleotidin tamamlayıcı bir nükleotid ile değiştirildiği karşılık gelen PM problarındaki diziyle çakışmaktadır. PM ve MM örneklerinin lüminesans yoğunluğunun oranı başlangıçta spesifik olmayan hibridizasyonun etkisini nötralize etmek için kullanıldı, ancak daha sonraki çalışmalar bu yaklaşımın doğruluğunu sorguladı.
Yüksek yoğunluklu mikrodiziler kullanılarak polimorfik lokusların tüm genom genotiplenmesi ( Illumina Human610-Quad BeadChip örneğini kullanarak)
Bugüne kadar önde gelen üreticiler (Illumina, Affymetrix, Sequenom, vb.) genotipleme ve gen ekspresyon analizi için yüksek yoğunluklu mikrodizilere sahip platformlar geliştirmiştir (Şekil 30).
Illumina Human610-Dörtlü Boncuk Çipi 600 binden fazla tek nükleotid polimorfizmi ve gen kopya sayısı varyasyonunun (CNV) belirteçlerini içerir. Biyoçip için her bir SNP, hastalıkla ilişkinin belirlenmesinde verimliliği artırmak amacıyla kendisi hakkındaki doğru bilgilere dayanarak seçilir. İnsan genomunda 10 milyondan fazla SNP bulunmaktadır ve genomdaki her polimorfik lokusu incelemek ekonomik olarak mümkün değildir. Illumina, yüksek kaliteli genotipleme verileri sağlayan ve hastalık duyarlılığı analizi için gerekli tüm lokusların kapsanmasını sağlayan, SNP seçimine yönelik benzersiz ve rasyonel bir yaklaşım geliştirmiştir.
Şekil 30. Yüksek verimli genotipleme için çip teknolojileri
Illumina biyoçipleri, genomdaki tüm yaygın SNP'ler (nadir alel frekansı ≥%5 ile) için proxy işaretçileri (temsili işaretçiler) olarak kullanılabilen, işaretçi veya etiket SNP'leri olarak adlandırılan bir dizi SNP içerir. İşaretleyici SNP'lerin seçimi, yakın konumdaki polimorfik lokuslar arasındaki bağlantı dengesizliğinin (r2) büyüklüğüne dayanmaktadır. İki SNP arasındaki yüksek korelasyonu gösteren yüksek r2 seviyesi, bu SNP'leri iyi proxy belirteçler haline getirir. Maksimum r2'nin 1'e eşit olması durumunda, iki SNP tam bağlantı dengesizliği içindedir ve mutlak vekil işaretleyiciler olarak hizmet edebilir; diğerinin genotipini bulmak için bir SNP'nin genotipini belirlemeniz gerekir (Akıllı SNP Seçiminin Gücü (www.illumina.com)). İşaretleyici SNP'lerin kullanımı, maksimum miktarda bilgi elde etmeyi, yüksek düzeyde genom kapsamını ve gen kapsamını elde etmeyi ve ayrıca genetik ilişkileri belirleme verimliliğini azaltmadan çalışma numunesinin boyutunu azaltmayı mümkün kılar. Genomik kapsam, bir referans lokus seti ile bağlantı dengesizliği içinde olan SNP'lerin sayısı olarak tanımlanır. Illumina uzmanları HapMap projesinde genotiplenen tüm SNP'leri referans seti olarak kullanıyor. Illumina'ya göre Human610-Quad BeadChip biyoçipi, Avrupa popülasyonlarındaki genomun %89'unu (CEU, HapMap), Asya genomunun %86'sını (CHB+JPT, HapMap) ve Afrika popülasyonlarındaki genomun %58'ini kapsıyor ( YRI, HapMap) (r2 > 0,8'de). Bu biyoçipteki işaretleyiciler arasındaki ortalama mesafe 4,7 kb, medyan ise 2,7 kb'dir.
Illumina'nın BeadArray teknolojisi, optik fiber demetleri veya düz silikon levhalar üzerinde mikro kuyucuklar halinde bir araya gelen 3 mikronluk silikon mikrokürelerin (boncuklar) kullanımına dayanmaktadır. Her bir mikroküre, lokusa özgü ve adres dizileri içeren binlerce spesifik oligonükleotid kopyasıyla kaplıdır; bunlardan ikincisi, hangi boncuğun hangi mikro hücreye gömüleceğini belirler.
Genotiplemenin ilk aşamasında, DNA örneklerinin genom çapında amplifikasyonu gerçekleştirilir ve ardından DNA parçalanır (Şekil 31). Bir sonraki aşamada, DNA örneklerinin etiketlenmemiş fragmanları, çipin mikrokürelerine sabitlenen karşılık gelen 50 nükleotidlik problarla hibridize edilir. Bundan sonra aleli doğru bir şekilde tanımlamak için, DNA polimeraz enzimi kullanılarak test nükleotidine etiketli bir tamamlayıcı nükleotid eklenir. Her işaretleyici için alellerin iki aşamalı tespiti - 50 nükleotid problarla hibridizasyon ve ardından nükleotidin enzimatik tespiti, alel tanımlaması için yüksek seçicilik ve özgüllük sağlar (Infinium® HD DNA Analizi BeadChips (www.illumina.com)).


Pirinç. 31. Illumina Human610 dörtlü BeadChip biyoçipleri (Infinium® HD DNA Analizi BeadChips (www.illumina.com) kullanılarak genotipleme protokolünün şeması.
Bu nedenle, sunulan ders kitabı kalıtsal insan hastalıklarını incelemek için ana moleküler genetik yöntemleri tartışmaktadır. Tek bir kitapta, mevcut tüm araştırma yöntemlerini veya kalıtsal patolojinin her bir spesifik formu için mevcut moleküler teşhis protokollerini açıklamak imkansızdır. Bu ders kitabı, moleküler genetik teşhisin metodolojisi ve stratejisi hakkında genel bir fikir vermekte ve modern bir araştırmacının uygulamasında en sık kullanılan yöntemleri ortaya koymaktadır. Çeşitli yöntemlerin resimlerle birlikte ayrıntılı bir açıklamasını içeren önerilen araştırma protokolleri, genetik alanında uzmanlaşmış tıbbi ve biyolojik eğitim öğrencilerinin, insan genomunu analiz etmek için moleküler genetik yöntemlerde başarılı bir şekilde uzmanlaşmalarına yardımcı olacaktır.
KULLANILAN REFERANSLARIN LİSTESİ
1. Bochkov N.P. Klinik genetik. M. 2011. – 592 s.
2. Glick B., Pasternak J. Moleküler biyoteknoloji. İlkeler ve Uygulama. - Moskova: Mir, 2002. - 589 s.
3. Gorbunova V.N., Baranov V.S. Kalıtsal hastalıkların moleküler tanısına ve gen tedavisine giriş. Saint Petersburg. "Özel Edebiyat". 1997. – 287 s.
4. Davis K. Genom analizi. Yöntemler. M. 1990. – 246 s.
5. Eprintsev A.T., Popov V.N., Fedorin D.N. Gen ifadesinin tanımlanması ve incelenmesi. // Üniversiteler için eğitimsel ve metodolojik el kitabı. - Voronej. – 2008. – 63 s.
6. Zhimulev I.F. Genel ve moleküler genetik. N. 2003. – 479 s.
7. Inge-Vechtomov S.G. Seçimin temelleri ile genetik. M. - 2010. – 718 s.
8. Kuzmina N.A. Biyoteknolojinin temelleri, 2005 // http://www.biotechnolog.ru/
9. Kulmamabetova G. Numune hazırlama. DNA/RNA izolasyonu için yöntemler // Biyolojinin modern sorunları, ENU, Astana, 2012, Ders 9.
10. Menşikova V.V. Klinik ve laboratuvar analitik teknolojileri ve ekipmanları. M. 2007. – 240 s.
11. Moleküler biyoteknoloji. İlkeler ve uygulama / ed. N.K. Yankovski. – M.: Mir, 2002. – 588 s.
12. Moleküler klinik teşhis. Yöntemler / ed. S. Herrington, J. McGee. – M.: Mir, 1999. – 558 s.
13. Mutovin G.R. Klinik genetik. Araştırmacı olmayan patolojinin genomiği ve proteomikleri: bir ders kitabı. M. 2010. – 832 s.
14. Mukhacheva T.A., Kovalev S.Yu. Uygulamalı biyoenformatik. Özel kurs. UrFU, Ekaterinburg. 2012.
15. Patrushev L.I. Gen ifadesi. M. Bilim. 2000. – 830 s.
16. PAAG'da Polyanichko A.M. Elektroforezi. Araç seti. Saint Petersburg. 2007.
17. Pritchard D.D. – Görsel tıbbi genetik. – başına. İngilizceden tarafından düzenlendi N.P. Bochkova. – M.: GEOTAR-Medya. – 2009. – 200 s.
18. Puzyrev V.P., Stepanov V.A. İnsan genomunun patolojik anatomisi. N. – 1997. – 224 s.
19. Gerçek zamanlı PCR / ed. D.V. Rebrikova. - M .: Binom., 2009. – 223 s.
20. Severin E.S. Biyokimya: Ders Kitabı. M. 2004. – 784 s.
21. Sukachev M. Hastalıkların tanı ve tedavisinde DNA'nın tam genom dizilişinin (kod çözme) modern yöntemleri // http://innoros.ru/publications/articles/13/
22. Telkov M. Gerçek zamanlı PCR: metodolojik temeller, optimizasyon, uygulama. Bio-Kırmızı Laboratuvarları.
23. Polimeraz zincir reaksiyonunun teorik temelleri. NPO "DNA-Teknolojisi" - Moskova, 1998 // www.dna-teknoloji.ru
24. Shatz V.D., Sakhartova O.V. Yüksek performanslı sıvı kromatografisi. Teorinin temelleri. Metodoloji. Tıbbi kimyada uygulama.
25. Mathew C.C. Yüksek moleküler ağırlıklı ökaryotik DNA'nın izolasyonu// moleküler biyolojide / ED yöntemleri. Walker J.M. – N.Y.: Haman basını. – 1984. – S. 31–34.
26. Nolan T, Hands RE, Bustin SA (2006). "Gerçek zamanlı RT-PCR kullanılarak mRNA'nın ölçülmesi." Nat. Protokol. 1:1559–1582. DOI:10.1038/nprot.2006.236. PMID17406449.
27. VanGuilder HD, Vrana KE, Freeman WM (2008). “Gen ekspresyonu analizi için yirmi beş yıllık kantitatif PCR.” Biyoteknikler 44: 619–626. DOI:10.2144/000112776. PMID18474036.
BAŞVURU
Ek 1.
DNA ekstraksiyonu için direktiflerin hazırlanması
İlgili bilgi.
DNA mikroçipi(eng. DNA mikrodizisi) moleküler biyoloji ve tıpta kullanılan karmaşık bir teknolojidir. DNA mikroçipi, dizisi bilinen tek sarmallı sentetik DNA parçalarının belirli bir sırayla yüksek yoğunlukta uygulandığı küçük bir yüzeydir. Bu fragmanlar, incelenmekte olan numuneden alınan, genellikle bir floresan boya ile etiketlenmiş tamamlayıcı DNA şeritlerinin hibridize olmasını (çift sarmallı moleküller oluşturmasını) sağlayan problar görevi görür. Numunede belirli bir diziye sahip DNA molekülleri ne kadar fazlaysa, tamamlayıcı proba o kadar fazla bağlanacak ve mikroçip üzerinde karşılık gelen probun "yerleştirildiği" noktada optik sinyal o kadar güçlü olacaktır. Hibridizasyondan sonra mikroçipin yüzeyi taranır ve sonuç olarak her bir DNA dizisine, karışımda belirli bir diziye sahip DNA moleküllerinin sayısıyla orantılı olarak belirli bir sinyal seviyesi atanır.
Geleneksel bir DNA mikroçipinde (Affymetrix tarafından yapılanlar gibi), problar katı bir yüzeye (bir cam veya silikon çip) bağlanır. Illumina tarafından üretilenler gibi diğer platformlarda büyük katı yüzeyler yerine mikroskobik boncuklar kullanılıyor. DNA mikrodizi teknolojisi, modern biyoloji ve tıpta karmaşık DNA karışımlarının (örneğin, bir hücredeki tüm transkriptlerin (mesajcı RNA) bütünlüğü) analizi için çok çeşitli uygulamalara sahiptir. DNA mikrodizileri, gen ifadesindeki değişiklikleri analiz etmek, tek nükleotid polimorfizmlerini tanımlamak, mutant genomları genotiplemek veya yeniden sıralamak için kullanılır. Mikroçipler tasarım, çalışma özellikleri, doğruluk, verimlilik ve maliyet açısından farklılık gösterir.
DNA mikrodizisinin kullanımına bir örnek
Aşağıda DNA mikrodizisinin kullanıldığı bir deneyin örneği verilmiştir.

- Biyolojik örnekler karşılaştırılmak üzere izole edilir veya büyütülür. Herhangi bir tedaviden önce ve sonra aynı bireylere (ikili karşılaştırma durumunda) veya örneğin hasta ve sağlıklı gibi farklı birey gruplarına karşılık gelebilirler.
- Saflaştırılmış nükleik asit numuneden izole edilir ve çalışmanın amacıdır: bu, bir gen ekspresyonu profilleme çalışmasındaki RNA, karşılaştırmalı bir genomik hibridizasyon çalışmasındaki DNA vb. olabilir. Bu örnek ilk duruma karşılık gelir.
- Elde edilen nükleik asidin niteliği ve miktarı kontrol edilir. Gereksinimler karşılanırsa deneye devam edilebilir.
- Mevcut RNA örneklerine dayanarak tamamlayıcı DNA dizileri (cDNA), ters transkripsiyon işlemi yoluyla sentezlenir.
- Amplifikasyon işlemi sırasında (ek DNA kopyalarının sentezi), numunelerdeki cDNA dizilerinin sayısı birçok kez artar.
- Floresan veya radyoaktif etiketler cDNA dizilerinin uçlarına bağlanır.
- Elde edilen numuneler gerekli kimyasallarla karıştırılarak mikroskobik bir delikten DNA mikroçiplerine uygulanır ve cDNA zincirlerinden birinin mikroçip üzerinde bulunan tamamlayıcı zincire bağlandığı hibridizasyon süreci başlar.
- Hibridizasyon işlemi tamamlandıktan sonra çipler, kalan materyalin uzaklaştırılması için yıkanır.
- Ortaya çıkan mikroçipler bir lazer kullanılarak taranır. Çıktı bir veya iki renkli görüntülerdir (kullanılan boya sayısına bağlı olarak).
- Her görüntünün üzerine bir ızgara eklenir, böylece hücrelerinin her biri, çipin aynı türden örneklere sahip bir bölümüne karşılık gelir. Bir ızgara hücresindeki numunelerin parlama yoğunluğuna belirli bir sayı atanır; bu sayı, ilk yaklaşımda, karşılık gelen numunede mevcut olan RNA dizilerinin sayısının bir ölçüsü olarak hizmet edebilir.
Sonuçların daha ileri düzeyde işlenmesi, karmaşık istatistiksel aygıtların çok aşamalı katılımını gerektirir.
Deneysel verilerin ön işlenmesi
Aynı geni temsil eden aynı DNA mikro dizisinden alınan iki numunenin yoğunlukları arasındaki korelasyon tipik olarak %95'i aşar. Bu gerçek genellikle çiplerle yapılan deneylerin iyi bir şekilde tekrarlanabilirliğinin doğrulanması olarak yorumlanır. Ancak aynı biyolojik materyal iki parçaya bölünürse ve bunlarla farklı mikrodiziler yapılırsa, ortaya çıkan yoğunluklar arasındaki korelasyon büyük olasılıkla %60 ila %80 arasında olacaktır. Çiplerin aynı çöpten alınan farelerden alınan numunelerle korelasyonu %30 kadar düşük olabilir. Deneyler farklı laboratuvarlarda yapılırsa sonuçları arasındaki korelasyon daha da düşük olabilir.
Yoğunlukların bu düşük tekrarlanabilirliği, çok sayıda varyasyon kaynağının birleşik etkilerinden kaynaklanmaktadır. Üç büyük gruba ayrılabilirler. Biyolojik çeşitlilik organizmaların doğal özelliklerini içerir. Teknik farklılıklar numune izolasyonu, boyama ve hibridizasyon aşamasında ortaya çıkar. Ölçüm hatası, bitmiş dizilerin taranmasıyla ilişkilidir ve sonuçları, örneğin tarayıcının içindeki tozdan etkilenebilir.
Teknik varyasyonun ve ölçüm hatasının etkilerinin nötralizasyonu, DNA mikrodizilerinin ön işleme aşamasında gerçekleştirilir.
Arka plan düzeltmesi
Arka plan düzeltme ihtiyacı, optik tanıma sisteminin gürültüsü (tarama sırasında elde edilen yoğunluk verileri "gerçek" numune yoğunluklarına eşit değildir) ve spesifik olmayan hibridizasyon (nükleotid dizilerinin yabancı maddelerin problarına bağlanması) gibi müdahale eden faktörlerin varlığıyla ilişkilidir. örnekler).
Normalleştirme
Veri normalizasyonu, bir deneyde dikkate alınan birkaç çipin birbiriyle karşılaştırılmaya uygun hale getirilmesini mümkün kılar. Bu aşamadaki analizin temel amacı mikrodiziler arasındaki sistematik biyolojik olmayan farklılıkların etkisini dışlamaktır. Bu tür farklılıkların kaynakları çoktur: ters transkripsiyonun verimliliğindeki farklılıklar, boya etiketleme, hibridizasyon, çipler arasındaki fiziksel farklılıklar, reaktif konsantrasyonlarındaki küçük farklılıklar ve laboratuvar koşullarındaki değişiklikler.
Normalleştirme yöntemi seçiminin analiz sonucu üzerinde önemli bir etkiye sahip olduğu gösterilmiştir.
Özetleme
Aynı dizilere karşılık gelen tüm örnekler için ifade düzeyi değerlerinin genelleştirilmesi
Kalite kontrol
Emisyon işleme
İstatistiksel işlemenin ana aşaması
Bağlantılar
- DNA mikrodizisi
- DNA mikrodizi deneyi - İngilizce Vikipedi'den makale
- DNA Mikrodizi Sanal Laboratuvarı - iki renkli DNA mikrodizi deneyinin adım adım etkileşimli örneği
- Mikrodizi Analizinin On Tuzağı - DNA mikrodizi analizinde yaygın hatalar
Spesifik sıra. Bir oligonükleotid, cDNA veya mRNA'ya hibritleşmek için kullanılan bir genin veya başka bir DNA bileşeninin kısa bir bölümü olabilir. Prob-hedef hibridizasyonu, floresans veya kemilüminesans kullanılarak tespit edilir ve ölçülür; bu, belirli bir sekansın nükleik asit miktarının bir numunede belirlenmesine olanak tanır.
Geleneksel bir DNA mikrodizisinde, problar katı bir yüzeye (bir cam veya silikon çip) kovalent olarak bağlanır. Illumina tarafından üretilenler gibi diğer platformlar, büyük katı yüzeyler yerine mikroskobik boncuklar kullanıyor. DNA mikrodizileri diğer mikrodizilerden yalnızca DNA'yı ölçmek için veya daha karmaşık bir DNA tespit ve analiz sisteminin parçası olarak kullanılmaları açısından farklılık gösterir.
DNA mikrodizileri, gen ifadesindeki değişiklikleri analiz etmek, tek nükleotid polimorfizmlerini tanımlamak, mutant genomları genotiplemek veya yeniden sıralamak için kullanılır. Mikroçipler tasarım, çalışma özellikleri, doğruluk, verimlilik ve maliyet açısından farklılık gösterir.
Hikaye
Notlar
Wikimedia Vakfı. 2010.
Diğer sözlüklerde “DNA mikroçipinin” ne olduğunu görün:
DNA mikroarray terimi İngilizce DNA mikroarray terimi Eş anlamlılar DNA çipi, DNA çipi, Gen çipi, DNA çipi Kısaltmalar İlgili terimler biyosensör, genom, DNA, DNA probu, çip üzerinde laboratuvar, RNA, oligonükleotid Tanımı... ile minyatür plaka. ..
DNA probu terimi İngilizce DNA probu terimi Eş anlamlılar Kısaltmalar İlgili terimler biyolojik nanonesneler, biyomedikal mikroelektromekanik sistemler, biyosensör, genom, DNA, DNA mikroçip, çip üzerinde laboratuvar, oligonükleotid... ... Ansiklopedik Nanoteknoloji Sözlüğü
DNA terimi İngilizcede DNA terimi Eş anlamlılar deoksiribonükleik asit Kısaltmalar DNA İlgili terimler gen aktarımı, aktüatör, bakteriyofaj, proteinler, biyolojik nanonesneler, biyomimetik, biyomimetik nanomalzemeler, genetik mühendisliği,... ... Ansiklopedik Nanoteknoloji Sözlüğü
DNA çipi
DNA biyoçipi- DNA Çipi DNA çipi (ayrıca: DNA biyoçipi, DNA mikroçipi, DNA nanoçipi) Genetik mutasyonları veya kaymaları tespit etmek ve hastalıkları teşhis etmek için kullanılan özel bir çip. Amerikan ordusu için uzmanlar tarafından geliştirilen bir biyoçip... ... Nanoteknoloji üzerine açıklayıcı İngilizce-Rusça sözlük. - M.
Mikroçip gen m mikrodizisi- Mikroçip, gen çipi veya mikroçip * mikrodizi veya gen çipi veya mikroçip, katı bir baz üzerinde hareketsiz hale getirilmiş, bilinen binlerce benzersiz tek sarmallı DNA fragmanından oluşan bir set. Bu parçalar her şeyi temsil ediyor... ... Genetik. ansiklopedik sözlük
Sir Edwin Mallor Southern (d. 7 Haziran 1938) İngiliz moleküler biyolog, Kraliyet Doğal Bilgiyi Geliştirme Derneği üyesi (aynı zamanda Londra Kraliyet Topluluğu olarak da bilinir), Lasker Ödülü sahibi (2005). Ödül... Vikipedi
Tamamlayıcı DNA içeren DNA mikrodizisi. Tamamlayıcı DNA (cDNA), ters transkriptaz tarafından katalize edilen bir reaksiyonda olgun mRNA'dan sentezlenen DNA'dır. Cha cDNA ... Vikipedi
Kantitatif nükleik asit analizi, bir karışım veya saf preparasyondaki DNA veya RNA konsantrasyonunu belirler. Nükleik asitleri içeren reaksiyonlar sıklıkla ilacın miktarı ve saflığı hakkında kesin bilgi gerektirir. Konsantrasyonu belirlemek için... ... Vikipedi
Amplifikasyon terimi İngilizce amplifikasyon terimi Eş Anlamlılar Kısaltmalar İlgili terimler Tanım (Latince amplificatio güçlendirme, artış), moleküler biyolojide, DNA'nın kopya sayısındaki artış. Açıklama Bir hücrede amplifikasyon... ... Ansiklopedik Nanoteknoloji Sözlüğü
Gen ifadesi bir genden (DNA nükleotid dizisi) gelen kalıtsal bilginin işlevsel bir ürüne (RNA veya protein) dönüştürüldüğü bir süreçtir. Gen ifadesinin düzenlenmesi, hücrelerin kendi yapılarını ve işlevlerini kontrol etmelerini sağlar ve hücre farklılaşmasının, morfogenezinin ve adaptasyonunun temelini oluşturur.
DNA çipleri analiz edilen bir numunede (genellikle biyolojik kökenli) belirtilen DNA dizilerinin varlığını belirlemenize olanak tanıyan benzersiz bir analitik araçtır (hibridizasyon analizi olarak adlandırılır). DNA çiplerini kullanarak analiz yapmak, alternatif teknolojileri (elektroforez, gerçek zamanlı PCR) kullanmaktan birkaç kat daha ucuzdur ve basit bir dedektörle laboratuvar dışında çalışmaya olanak tanır.
İlk kez DNA çipi 1980'lerin sonlarında araştırmalarda kullanıldı. Pek çok genin ifadesinin eş zamanlı analizine olanak tanıyan, artık yaygınlaşan bu yöntem, mRNA veya cDNA hedeflerinin, bir mikroçip üzerinde hareketsizleştirilmiş tek sarmallı DNA parçalarıyla hibridizasyonu yoluyla tanınması ilkesine dayanmaktadır. Modern bir DNA mikroçipi şunlardan oluşur: binlerce deoksioligonükleotid (problar veya örnekler), mikroskobik noktalar şeklinde gruplandırılmış ve katı bir destek üzerine sabitlenmiştir. Her nokta, spesifik bir nükleotid dizisine sahip birkaç pikomol DNA içerir. DNA mikrodizi oligonükleotidleri, genlerin veya diğer fonksiyonel DNA elemanlarının kısa bölümleri olabilir ve cDNA veya mRNA (cRNA) ile hibridizasyon için kullanılır. Prob-hedef hibridizasyonu, floresans veya kemilüminesans kullanılarak tespit edilir ve ölçülür; bu, belirli bir sekansın nükleik asit miktarının bir numunede belirlenmesine olanak tanır.
Geleneksel bir DNA mikrodizisinde, problar katı bir yüzeye (bir cam veya silikon çip) kovalent olarak bağlanır. Illumina tarafından üretilenler gibi diğer platformlarda büyük katı yüzeyler yerine mikroskobik boncuklar kullanılıyor.
DNA mikrodizileri, gen ifadesindeki değişiklikleri analiz etmek, tek nükleotid polimorfizmlerini tanımlamak, mutant genomları genotiplemek veya yeniden sıralamak için kullanılır. Mikroçipler tasarım, çalışma özellikleri, doğruluk, verimlilik ve maliyet açısından farklılık gösterir.
DNA mikrodizileri:
cDNA mikrodizileri
oligonükleotid
(floresan algılamalı iki renkli)
oligonükleotid
(Affymetrix, floresan algılamalı monokromatik)
membran c-DNA mikrodizileri
(radyoaktif algılama ile)
Jel c-DNA çipleri
Protein mikroçipleri
Biraz tarih
1980'ler: protein çipleri
~1991: bir substrat üzerinde DNA sentezi kimyası (yüksek yoğunluk) - Affymetrix oligonükleotid çipleri (Fodor, Stryer, Lockhart)
~1995: mikro kazı robotları – Stanford Üniversitesi cDNA çipleri (Pat Brown ve Dari Shalon)
1990'lar: MPI jel çipleri
Ancak 1982 yılında Augenlicht ve Kobrin bir DNA dizilimi önerdiler ( Kanser Araştırma) ve 1984 yılında kanser hücrelerinin incelenmesi için 4000 element içeren bir çip yaptılar.
(Makale reddedildi BilimVe Doğa)
DNA mikrodizileri kullanılarak neler incelenebilir?
Çeşitli dokularda gen ifadesi
Normal ve patolojik durumlarda gen ekspresyonu (normal ve kanser hücrelerinde)
Dış etkilerin (bir patojenle hücre etkileşimi, ilaç) bir sonucu olarak zaman içinde gen ifadesinde meydana gelen değişiklikler
İfade profilleri(örüntüler) normal ve kanser hücreleri veya farklı kanser türleri arasında farklılık gösterir. Tedavi edilebilir ve tedavi edilemez lösemi türleri farklı modeller üretir. Desenlerin türüne göre hastalığın seyrini çok erken bir aşamada yüksek olasılıkla tahmin etmek mümkündür.
İfade mikroçipleri
Mikrodizi teknolojisinin kullanıldığı aktif olarak geliştirilen alanlardan biri, karmaşık hastalıklarda transkripsiyonel profillerin incelenmesidir. Vücudumuzdaki tüm hücreler aynı kalıtsal genomik DNA'ya sahip olmasına rağmen, her hücre, hücre tipine, biyolojik süreçlere, normal veya patolojik duruma vb. göre mRNA formunda farklı genleri ifade eder. Gen ekspresyon profillerindeki bu çeşitlilik, biyolojik ve klinik önemi nedeniyle yoğun çalışmalara konu olmuştur. Mikrodizi teknolojisinin yüzlerce ve binlerce genin ifadesini analiz etme yeteneğinin, kanser gibi karmaşık bir hastalığın şifresini çözerken en çok talep gören özellik olduğu kanıtlanmıştır. Mikrodizi teknolojisi, onbinlerce genin ifadesinin aynı anda izlenmesini mümkün kılarak bir hücrenin moleküler portresini oluşturur. Gen ekspresyon profili oluşturmanın en önemli sonuçları birçok kanserde teşhis, sınıflandırma ve prognozu içerir. Her ne kadar sitogenetik inceleme ve çeşitli moleküler belirteçlerin analizi ile tamamlanan histopatolojik değerlendirme, teşhis koyma ve prognozu belirlemede hala altın standart olsa da, son çalışmalar çoğu durumda bunun yerine gen ekspresyon profillemesinin yapılabileceğini göstermektedir. Kanserin teşhisi ve prognozu, onkologlar, patologlar ve sitogenetikçiler gibi çeşitli uygulayıcıların ortak uzmanlığını gerektirir; ayrıca nihai sonuçlar, uzmanların metodolojik yaklaşımlarına ve niteliklerine bağlı olarak farklılık gösterebilir. Mikroçipler birçok uzmanın çabalarının yerini tamamen alabilir, ayrıca teşhis ve prognozdaki doğruluğu artırabilir ve analiz için tek bir standart platform sağlayabilir.
Gen ifadesini analiz etmek için iki tür mikrodizi kullanılır: tamamlayıcı DNA'ya (cDNA) dayalı ve oligonükleotid problara dayalı. cDNA bazlı mikrodiziler, standart mikroskobik camların veya diğer katı desteğin yüzeyine monte edilen DNA parçalarıdır. Oligonükleotid mikrodizilerinde, 25-60 nükleotid bazı (nt) uzunluğundaki oligonükleotidler aynı substrat üzerinde immobilize edilir. Mikroarray analizi için numune hazırlama prosedürü Şekil 2'de gösterilmektedir. 2. Hücrelerden toplam RNA izole edilir (bazen bir mRNA fraksiyonu da izole edilir), ardından mRNA'nın poliA-terminal fragmanına tamamlayıcı bir sekans ve T7 RNA polimerazın bir bölgesini içeren kombine bir primer kullanılarak ters transkripsiyon reaksiyonu gerçekleştirilir. organizatör. Sentezlenen cDNA zincirine T7 RNA polimeraz promotör dizisinin dahil edilmesi, daha fazla in vitro amplifikasyon reaksiyonlarına izin verir: T7 RNA polimeraz enzimi, bir test tüpündeki her cDNA molekülünden çok sayıda RNA kopyası üretir. Orijinal mRNA'nın doğrusal amplifikasyonu bu şekilde gerçekleşir. Kural olarak, ortaya çıkan RNA molekülleri, reaksiyonda floresan etiket içeren nükleotidler kullanılarak eşzamanlı olarak etiketlenir. Oligonükleotid mikrodizileriyle yapılan deneylerde, bir tamamlayıcı RNA (cRNA) örneğini etiketlemek için genellikle bir tür floresan etiket kullanılır ve gen ekspresyon seviyeleri, elde edilen floresan sinyallerin mikrodizinin dahili kontrol noktalarıyla karşılaştırılmasıyla belirlenir. CDNA bazlı mikrodizilerle çalışırken, deneyde kural olarak iki örnek kullanılır: kontrol örneği bir floresan boyayla etiketlenir, test örneği başka biriyle etiketlenir, ardından karıştırılıp bir mikroçip ile hibritlenir. Mikroçipin her hücresindeki iki farklı floresan etiketin oranına bağlı olarak, belirli bir genin ekspresyon seviyesindeki artış veya azalmaya karar verilir. Teknoloji platformundan bağımsız olarak her deney, onlarca ve yüzbinlerce genin ifade düzeyine ilişkin bir tahmin içeren veriler üretir. Bu kadar çok veriyi işlemek için, öncelikle küme analizi olmak üzere oldukça karmaşık bir matematiksel aygıt kullanılır. Mikrodizi verileri, klinik verilerle ilişkili olarak (hipotez odaklı analiz) veya hastanın herhangi bir klinik özelliği dikkate alınmaksızın (denetimsiz analiz) analiz edilebilir.
Klasik yöntemler aynı anda birkaç genin ifadesinin analizine izin verir veya örneğin aşağıdakiler gibi özel mikrodizi teknolojilerinin kullanılmasını gerektirir: Afimetrix. Affymetrix, GeneChip® mikrodizileri üretmek için fotolitografi ve kimyasal oligonükleotid sentezinin bir kombinasyonunu kullanır.
SARI- eğer gen hem hastalıklı (Cy5) hem de normal (Cy3) dokularda eksprese edilirse, hem kırmızı hem de yeşil boyalarla etiketlenen DNA bu noktada hibritleşerek sarı bir renk elde edecektir.
KIRMIZI- eğer gen yalnızca hastalıklı (Cy5) dokuda eksprese edilirse, bu noktada yalnızca kırmızı boyayla etiketlenmiş DNA hibridize olur
YEŞİL- eğer gen yalnızca sağlıklı (Cy3) dokuda ifade ediliyorsa, bu noktada yalnızca yeşil boyayla işaretlenmiş DNA hibridize olur
SİYAH– eğer gen hastalıklı veya sağlıklı dokuda ifade edilmiyorsa
Böylece,
DNA mikrodizileri, binlerce genin ifadesine ilişkin bilgilerin aynı anda analiz edilmesini mümkün kılar.
Şu anda kullanımda olan ana DNA mikrodizileri türleri, Affymetrix'in cDNA mikrodizileri ve oligonükleotid çipleridir.
cDNA mikrodizileri, çeşitli floresan boyalarla etiketlenmiş karışık deney ve kontrol örneklerinin, yüzeyinde ~10.000-20.000 gene karşılık gelen çift sarmallı c-DNA'nın uygulandığı bir çipe hibridizasyonuna dayanır.
Affimetrix mikroçipleri, deneysel bir numunenin biyotin etiketli cRNA'sının, bir çip substratı üzerinde sentezlenen bir dizi Perfect Match ve Mismatch oligonükleotidleri ile hibridizasyonuna ve ardından streptavidin-fikoeritrin ile boyanmasına dayanmaktadır. GeneChip İnsan Genomu U133 Plus 2.0, 38.500 karakterize edilmiş gen dahil olmak üzere 47.000 transkriptin eş zamanlı analizine olanak tanır. Mikroçip, çeşitli tiplerde 1.300.000 oligonükleotit içerir.
Elde edilen verilerin analizi, özel istatistiksel yöntemler kullanılarak çok aşamalı matematiksel işlemler gerektirir.
Pratik açıdan bakıldığında, günümüzde mikroçiplerin kullanımı aşağıdaki sorunların çözülmesini mümkün kılmaktadır:
doğru tanı, hastalığın yeni alt tiplerinin belirlenmesi, sınıflandırmanın açıklığa kavuşturulması;
hastalığın seyrini ve klinik sonucunu tahmin etmek, onkohematolojik hastalıkların patogenezinde yer alan genleri ve sinyal yolaklarını belirlemek, hedefe yönelik farklılaştırılmış tedavi için yeni hedefler aramak;
mikroçip teknolojisine dayalı olanlar da dahil olmak üzere daha basit ve daha ucuz teşhis testlerinin geliştirilmesi ve oluşturulması (onlarca ve yüzbinlerce gen yerine onlarca veya yüzlerce gen için örnekler içeren mikroçipler);
Mikrodizilerin prospektif klinik araştırmalara dahil edilmesi, mikrodizi analiz sonuçlarının klinik tedavi protokollerine dahil edilmesi için doğrulanması, mikrodizi teknolojisi kullanılarak elde edilen hastalıkların doğasına ilişkin yeni verileri dikkate alarak klinik protokollerin tasarlanması.
DNA mikrodizileri
DNA çipleri, analiz edilen bir numunede (genellikle biyolojik kökenli) belirtilen DNA dizilerinin varlığını belirlemenizi sağlayan benzersiz bir analitik araçtır (hibridizasyon analizi olarak adlandırılır). DNA çiplerini kullanarak analiz yapmak, alternatif teknolojileri (elektroforez, gerçek zamanlı PCR) kullanmaktan birkaç kat daha ucuzdur ve basit bir dedektörle laboratuvar dışında çalışmaya olanak tanır.
DNA çipleri ilk olarak geçen yüzyılın 80'li yıllarının sonlarında araştırmalarda kullanıldı. Pek çok genin ifadesinin eş zamanlı analizine olanak tanıyan, artık yaygınlaşan bu yöntem, mRNA veya cDNA hedeflerinin, bir mikroçip üzerinde hareketsizleştirilmiş tek sarmallı DNA parçalarıyla hibridizasyonu yoluyla tanınması ilkesine dayanmaktadır.
Bir DNA çipi, üzerinde farklı uzunluklarda (genellikle kovalent olarak) tek sarmallı DNA fragmanlarının hareketsizleştirildiği katı bir destektir: kısa - 15-25 nükleotid, uzun - 25-60 nükleotid ve cDNA fragmanları - 100 ila 3000 nükleotid arasında. Substrat malzemeleri olarak cam, silikon, çeşitli polimerler, hidrojeller (örneğin poliakrilamide dayalı) ve hatta altın kullanılır. En yaygın alt tabakalar camdır.
Protein ve peptid çipleri
Gen çevirisinin ürünlerini analiz etmek için polipeptitler temelinde oluşturulan çipler kullanılır. Çoğu ilaç hedefi proteindir, dolayısıyla protein ve peptid çipleri ilaç keşfi için faydalı olabilir. Protein mikroçipleri, vücudun bağışıklık durumunu belirlemek, alerjik duyarlılığı tespit etmek ve belirli alerjenleri tanımlamak için minyatür analitik sistemler olarak tıpta son derece yararlı olabilir. Ana patojen organizmaların (bakteriler, mantarlar ve virüsler) ana antijenlerinin bir koleksiyonunu temsil eden mikroçipler, kan numunelerinin aynı anda yüzlerce ve binlerce antikorun varlığı açısından analiz edilmesini ve enfeksiyonların hızlı bir şekilde tanımlanmasını mümkün kılar.Sinyal kayıt yöntemleri şunlardır: protein mikroçiplerinin geliştirilmesinde büyük önem taşımaktadır. Bunlar şunları içerir: bilinen ilk yöntem - radyoaktif bir etiket kullanan RIA (radyoimmünoanaliz), floresan etiketler kullanan immünoanaliz - FIA ve etiketin bir antikor molekülüne kovalent olarak bağlı bir enzim molekülü olduğu enzim bağlantılı immünosorbent testi (ELISA) . ELISA'da etiket olarak yüksek derecede aktif stabil enzimler (alkalin fosfataz, peroksidaz vb.) seçilir. ELISA'nın avantajı çoklu sinyal amplifikasyonu olasılığıdır. Son yıllarda ELF-97 gibi çözünmeyen floresan ürünler veren hassas substrat sistemleri geliştirildi. Açıktır ki, bir protein mikroçipinin üretim prosesi, mikroçip üzerinde sabitleme ve immobilizasyon prosedürünü içermelidir. Yöntemin seçimi birçok parametre tarafından belirlenir - ilk substratın doğası, mikroçipin sonraki uygulama alanı vb. Protein mikroçipleri, öncelikle kan serumu/plazma, idrar, beyin omurilik sıvısı, tükürük, gözyaşı sıvısı, amniyotik sıvı vb. dahil bilinen (ve mevcut) tüm biyolojik sıvıların analizi için aktif olarak kullanılır.