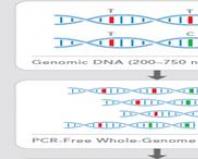
DNK čipovi. Supramolekularni nanoprinting. Upotreba u medicini i genetici
Tehnologija proizvodnje i dizajn glavne su determinante prednosti i mana bioloških mikročipova, njihove primjene, cjenovnih karakteristika i ukupne dostupnosti.
Postoje dva fundamentalno različita pristupa proizvodnji DNK čipova: sinteza DNK date sekvence direktno na matrici i hemijska imobilizacija prethodno sintetizovanih oligonukleotida na supstratu. Tehnologiju za sintezu oligonukleotida na supstratu fotolitografijom patentirao je i koristi Affymetrix, svjetski lider u proizvodnji DNK čipova, koji kontrolira do 70% globalnog tržišta. Tehnologija se zasniva na korištenju fotolabilne zaštitne grupe za monomerne DNK jedinice, koja se uklanja sa terminalnog ostatka oligonukleotida sintetiziranog na supstratu nakon zračenja UV svjetlom. Prednost ove tehnologije je mogućnost proizvodnje čipova sa vrlo velikom gustinom taloženja - do 100.000 tačaka po 1 cm2. Očigledan nedostatak metode je složenost i visoka cijena procesa.
Tehnologije za hemijsku imobilizaciju fragmenata DNK na čvrstim supstratima počele su da se razvijaju prije oko 30 godina i trenutno se nastavljaju usavršavati. Opći princip imobilizacije bioloških molekula je formiranje para kemijskih grupa na površini supstrata i na kraju spojenog oligonukleotida, osiguravajući stvaranje kovalentne veze između njih. Postoji ogroman broj takvih metoda, od kojih se većina zasniva na interakciji nukleofilne grupe (na primjer, amino grupe), koja se nalazi na površini supstrata ili je vezana za oligonukleotidnu molekulu, s elektrofilnim agensom, koji mogu se na ovaj ili onaj način aktivirati karboksilnim kiselinama, monoesterima fosforne kiseline itd.
Procjena ekspresije gena korištenjem DNK mikromreža ( koristeći primjer Affymetrix GeneChip)
Najčešća upotreba DNK mikromreža je za procjenu ekspresije gena. Najpopularnija platforma za rješavanje ove klase problema su Affymetrix GeneChip mikronizovi, koji koriste kratke sekvence oligonukleotida za identifikaciju gena sadržanih u uzorku RNK. Prisustvo svakog gena u uzorku detektuje se pomoću seta sondi od svakih 25 nukleotida. Da bi se poboljšao kvalitet eksperimenta, nekoliko kopija sondi se postavlja na čip za svaku sekvencu koja se razmatra.
Affymetrix mikronizovi obično koriste 11 do 20 parova uzoraka po genu od interesa. Jedna komponenta takvih parova, nazvana sonda savršenog podudaranja (PM), upravo je komplementarna sekvenci odgovarajućeg gena – podrazumijeva se da će se njegova RNK vezati za PM sondu. Ovo spajanje se naziva specifičnom hibridizacijom. Međutim, nukleotidne sekvence drugih gena mogu biti vezane za sonde (nespecifična hibridizacija). Da bi se procenio uticaj nespecifične hibridizacije, koriste se druge komponente para - sonde koje se nazivaju mismatch sonda (MM). Nukleotidna sekvenca u njima se poklapa sa sekvencom u odgovarajućim PM sondama pri čemu je centralni (trinaesti) nukleotid zamijenjen komplementarnim. Omjer intenziteta luminiscencije uzoraka PM i MM prvobitno je korišten za neutralizaciju efekta nespecifične hibridizacije, ali su kasnije studije dovele u pitanje ispravnost ovog pristupa.
Genotipizacija cijelog genoma polimorfnih lokusa korištenjem mikromreža visoke gustine ( koristeći primjer Illumina Human610-Quad BeadChip)
Do danas, vodeći proizvođači (Illumina, Affymetrix, Sequenom, itd.) razvili su platforme sa mikromrežama visoke gustine za genotipizaciju i analizu ekspresije gena (Sl. 30)
Illumina Human610-Quad BeadChip uključuje više od 600 hiljada pojedinačnih nukleotidnih polimorfizama i markera varijacije broja kopija gena (CNV). Svaki SNP za biočip se bira na osnovu tačnih informacija o njemu kako bi se poboljšala efikasnost utvrđivanja povezanosti sa bolešću. U ljudskom genomu postoji više od 10 miliona SNP-a, a proučavanje svakog polimorfnog lokusa u genomu nije ekonomski izvodljivo. Illumina je razvila jedinstven, racionalan pristup selekciji SNP-a koji osigurava visokokvalitetne podatke o genotipizaciji i pokrivanje svih potrebnih lokusa za analizu osjetljivosti na bolesti.
Fig.30. Čip tehnologije za genotipizaciju visoke propusnosti
Illumina biočipovi uključuju skup SNP-ova, koji se nazivaju SNP-ovi markera ili oznake, koji se mogu koristiti kao proxy markeri (reprezentativni markeri) za sve uobičajene SNP-ove (sa rijetkom frekvencijom alela ≥ 5%) u genomu. Izbor SNP-ova markera zasniva se na veličini neravnoteže veze (r 2) između blisko lociranih polimorfnih lokusa. Visok nivo r 2 između dva SNP-a, što ukazuje na visoku korelaciju, čini ove SNP-ove dobrim proxy markerima. Pri maksimalnom r 2 jednakom 1, dva SNP-a su u potpunoj neravnoteži veza i mogu poslužiti kao apsolutni proxy markeri, tj. morate genotipizirati jedan SNP da biste saznali genotip drugog (Moć inteligentnog odabira SNP-a (www.illumina.com)). Upotreba markerskih SNP-ova omogućava dobijanje maksimalne količine informacija, visok nivo pokrivenosti genoma i pokrivenosti genom, a takođe i smanjenje veličine uzorka istraživanja bez smanjenja efikasnosti određivanja genetskih asocijacija. Genomska pokrivenost je definirana kao broj SNP-ova koji su u neravnoteži veza s referentnim skupom lokusa. Illumina stručnjaci koriste sve SNP-ove genotipizirane u HapMap projektu kao referentni set. Prema Illumini, biočip Human610-Quad BeadChip pokriva 89% genoma u evropskim populacijama (CEU, HapMap), 86% genoma u Aziji (CHB+JPT, HapMap) i 58% genoma u Africi ( YRI, HapMap) (na r 2 > 0,8). Prosječna udaljenost između markera na ovom biočipu je 4,7 kb, medijana je 2,7 kb.
Tehnologija Illumina BeadArray zasnovana je na upotrebi silikonskih mikrosfera (perli) od 3 mikrona, koje se same sklapaju u mikro jažice bilo na snopovima optičkih vlakana ili na ravnim silikonskim pločicama. Svaka mikrosfera je prekrivena hiljadama kopija specifičnih oligonukleotida koji sadrže sekvence specifične za lokus i adrese, od kojih potonje određuju koje je zrno ugrađeno u koju mikroćeliju.
U prvoj fazi genotipizacije vrši se amplifikacija uzoraka DNK u cijelom genomu, nakon čega se DNK fragmentira (slika 31). U sljedećoj fazi, neobilježeni fragmenti uzoraka DNK hibridiziraju se s odgovarajućim sondama od 50 nukleotida fiksiranih na mikrosferama čipa. Nakon toga, da bi se tačno identificirao alel, označeni komplementarni nukleotid je vezan za test nukleotid pomoću enzima DNK polimeraze. Detekcija alela u dva koraka za svaki marker - hibridizacija sa sondama od 50 nukleotida i naknadna enzimska detekcija nukleotida obezbeđuje visoku selektivnost i specifičnost za identifikaciju alela (Infinium® HD DNA Analysis BeadChips (www.illumina.com)).


Rice. 31. Šema protokola genotipizacije pomoću Illumina Human610 quad BeadChip biočipova (Infinium® HD DNK Analysis BeadChips (www.illumina.com).
Dakle, predstavljeni udžbenik razmatra glavne molekularno genetske metode za proučavanje nasljednih ljudskih bolesti. U jednoj knjizi nemoguće je opisati sve postojeće metode istraživanja ili predstaviti molekularne dijagnostičke protokole za svaki konkretan oblik nasljedne patologije. Ovaj udžbenik daje opću ideju o metodologiji i strategiji molekularne genetičke dijagnostike, te otkriva metode koje se najčešće koriste u praksi suvremenog istraživača. Predloženi protokoli istraživanja, detaljan opis različitih metoda sa ilustracijama, pomoći će studentima medicinskog i biološkog usavršavanja specijalizovanih za genetiku da uspješno savladaju molekularno genetske metode za analizu ljudskog genoma.
LISTA KORIŠTENE REFERENCE
1. Bočkov N.P. Klinička genetika. M. 2011. – 592 str.
2. Glick B., Pasternak J. Molekularna biotehnologija. Principi i primjena. - Moskva: Mir, 2002. - 589 str.
3. Gorbunova V.N., Baranov V.S. Uvod u molekularnu dijagnostiku i gensku terapiju nasljednih bolesti. Sankt Peterburg. "Specijalna literatura". 1997. – 287 str.
4. Davis K. Analiza genoma. Metode. M. 1990. – 246 str.
5. Eprintsev A.T., Popov V.N., Fedorin D.N. Identifikacija i proučavanje ekspresije gena. // Obrazovno-metodički priručnik za sveučilišta. - Voronjež. – 2008. – 63 str.
6. Zhimulev I.F. Opća i molekularna genetika. N. 2003. – 479 str.
7. Inge-Vechtomov S.G. Genetika sa osnovama selekcije. M. - 2010. – 718 str.
8. Kuzmina N.A. Osnove biotehnologije, 2005. // http://www.biotechnolog.ru/
9. Kulmamabetova G. Priprema uzorka. Metode izolacije DNK/RNA // Savremeni problemi biologije, ENU, Astana, 2012, Predavanje 9.
10. Menshikova V.V. Kliničke i laboratorijske analitičke tehnologije i oprema. M. 2007. – 240 str.
11. Molekularna biotehnologija. Principi i primjena / ur. N.K. Yankovsky. – M.: Mir, 2002. – 588 str.
12. Molekularna klinička dijagnostika. Metode / ur. S. Herrington, J. McGee. – M.: Mir, 1999. – 558 str.
13. Mutovin G.R. Klinička genetika. Genomika i proteomika neistraživačke patologije: udžbenik. M. 2010. – 832 str.
14. Mukhacheva T.A., Kovalev S.Yu. Primijenjena bioinformatika. Specijalni kurs. UrFU, Ekaterinburg. 2012.
15. Patrushev L.I. Ekspresija gena. M. Science. 2000. – 830 str.
16. Polyanichko A. M. Elektroforeza u PAAG. Toolkit. Sankt Peterburg. 2007.
17. Pritchard D.D. – Vizuelna medicinska genetika. – per. sa engleskog uređeno od N.P. Bochkova. – M.: GEOTAR-Media. – 2009. – 200 str.
18. Puzyrev V.P., Stepanov V.A. Patološka anatomija ljudskog genoma. N. – 1997. – 224 str.
19. PCR u realnom vremenu / ur. D.V. Rebrikova. - M.: Binom., 2009. – 223 str.
20. Severin E.S. Biohemija: Udžbenik. M. 2004. – 784 str.
21. Sukachev M. Moderne metode sekvenciranja (dekodiranja) DNK u cijelom genomu u dijagnostici i liječenju bolesti // http://innoros.ru/publications/articles/13/
22. Telkov M. PCR u realnom vremenu: metodološke osnove, optimizacija, primena. Bio-Red Laboratories.
23. Teorijske osnove lančane reakcije polimeraze. NPO "DNA-Technology" - Moskva, 1998 // www.dna-technology.ru
24. Shatz V.D., Sakhartova O.V. Tečna hromatografija visokih performansi. Osnove teorije. Metodologija. Primjena u medicinskoj hemiji.
25. Mathew C.C. Izolacija eukariotske DNK visoke molekularne težine// Metode u molekularnoj biologiji / ED. Walker J.M. – N.Y.: Haman press. – 1984. – Str. 31–34.
26. Nolan T, Hands RE, Bustin SA (2006). "Kvantifikacija mRNA koristeći RT-PCR u realnom vremenu." Nat. Protoc. 1:1559–1582. DOI:10.1038/nprot.2006.236. PMID 17406449.
27. VanGuilder HD, Vrana KE, Freeman WM (2008). “Dvadeset pet godina kvantitativnog PCR-a za analizu genske ekspresije.” Biotechniques 44: 619–626. DOI:10.2144/000112776. PMID 18474036.
PRIMJENA
Aneks 1.
Priprema direktiva za ekstrakciju DNK
Povezane informacije.
DNK mikročip(eng. DNA microarray) je kompleksna tehnologija koja se koristi u molekularnoj biologiji i medicini. DNK mikročip je mala površina na koju se nanose fragmenti jednolančane sintetičke DNK sa poznatom sekvencom velikom gustoćom u određenom redoslijedu. Ovi fragmenti djeluju kao sonde s kojima se komplementarni lanci DNK iz uzorka koji se proučava, obično označeni fluorescentnom bojom, hibridiziraju (formiraju dvolančane molekule). Što je više molekula DNK s određenom sekvencom u uzorku, to će se više njih vezati za komplementarnu sondu, a optički signal će biti jači na mjestu na mikročipu gdje je odgovarajuća sonda “posađena”. Nakon hibridizacije, površina mikročipa se skenira, i kao rezultat, svakoj DNK sekvenci se dodeljuje određeni nivo signala, proporcionalan broju molekula DNK sa datom sekvencom koja je prisutna u mešavini.
U konvencionalnom DNK mikročipu (kao što su oni koje proizvodi Affymetrix), sonde su pričvršćene na čvrstu površinu - stakleni ili silikonski čip. Druge platforme, poput onih koje proizvodi Illumina, koriste mikroskopske perle umjesto velikih čvrstih površina. Tehnologija DNK mikromreža ima širok spektar primjena u modernoj biologiji i medicini za analizu složenih mješavina DNK - na primjer, ukupnost svih transkripata (messenger RNA) u ćeliji. DNK mikronizovi se koriste za analizu promjena u ekspresiji gena, identifikaciju polimorfizama pojedinačnih nukleotida, genotipizaciju ili ponovno sekvenciranje mutantnih genoma. Mikročipovi se razlikuju po dizajnu, radnim karakteristikama, tačnosti, efikasnosti i ceni.
Primjer korištenja DNK mikromreže
Ispod je primjer eksperimenta koji koristi DNK mikromrežu.

- Biološki uzorci se izoluju ili uzgajaju za upoređivanje. Oni mogu odgovarati istim pojedincima prije i poslije bilo kakvog tretmana (slučaj parnih poređenja), ili različitim grupama pojedinaca, na primjer, bolesni i zdravi, itd.
- Pročišćena nukleinska kiselina je izolirana iz uzorka i predmet je proučavanja: to može biti RNK u studiji profiliranja ekspresije gena, DNK u komparativnoj studiji genomske hibridizacije, itd. Ovaj primjer odgovara prvom slučaju.
- Provjerava se kvalitet i količina dobivene nukleinske kiseline. Ako su zahtjevi ispunjeni, eksperiment se može nastaviti.
- Na osnovu dostupnih uzoraka RNK, komplementarne DNK sekvence (cDNK) se sintetišu kroz proces reverzne transkripcije.
- Tokom procesa amplifikacije (sinteze dodatnih kopija DNK), broj cDNK sekvenci u uzorcima se višestruko povećava.
- Fluorescentne ili radioaktivne oznake su pričvršćene za krajeve cDNK sekvenci.
- Dobijeni uzorci, pomiješani sa potrebnim hemikalijama, se nanose na DNK mikročipove kroz mikroskopsku rupu i počinje proces hibridizacije, tokom kojeg se jedan od cDNK lanaca vezuje za komplementarni lanac prisutan na mikročipu.
- Nakon što je proces hibridizacije završen, čips se ispere kako bi se uklonio sav preostali materijal.
- Dobijeni mikročipovi se skeniraju laserom. Izlaz su jednobojne ili dvobojne slike (ovisno o broju korištenih boja).
- Na svaku sliku je postavljena mreža, tako da svaka njena ćelija odgovara dijelu čipa sa uzorcima istog tipa. Intenzitetu sjaja uzoraka u ćeliji rešetke pripisuje se određeni broj, koji u prvoj aproksimaciji može poslužiti kao mjera za broj RNK sekvenci prisutnih u odgovarajućem uzorku.
Dalja obrada rezultata zahtijeva višestepeno uključivanje složenog statističkog aparata.
Predobrada eksperimentalnih podataka
Korelacija između intenziteta dva uzorka iz istog DNK mikroniza koji predstavlja isti gen obično prelazi 95%. Ova činjenica se često tumači kao potvrda dobre ponovljivosti eksperimenata sa čipovima. Međutim, ako se isti biološki materijal podijeli na dva dijela i sa njima se naprave različiti mikronizovi, korelacija između dobijenih intenziteta će najvjerovatnije biti između 60 i 80%. Korelacija na čipovima sa uzorcima uzetim od miševa iz istog legla može biti i do 30%. Ako se eksperimenti izvode u različitim laboratorijama, korelacija između njihovih rezultata može biti još niža.
Ova niska ponovljivost intenziteta je rezultat kombinovanih efekata velikog broja izvora varijacije. Mogu se podijeliti u tri velike grupe. Biološka varijacija uključuje inherentne karakteristike organizama. Tehničke varijacije se javljaju u fazi izolacije uzorka, bojenja i hibridizacije. Greška mjerenja je povezana sa skeniranjem gotovih nizova, na čije rezultate može utjecati, na primjer, prašina unutar skenera.
Neutralizacija efekata tehničkih varijacija i greške merenja vrši se u fazi predprocesiranja DNK mikronizova.
Korekcija pozadine
Potreba za korekcijom pozadine povezana je sa prisustvom takvih faktora interferencije kao što su šum sistema optičkog prepoznavanja (podaci o intenzitetu dobijeni tokom skeniranja nisu jednaki "stvarnim" intenzitetima uzorka) i nespecifična hibridizacija (vezivanje nukleotidnih sekvenci za sonde stranih uzoraka). uzorci).
Normalizacija
Normalizacija podataka omogućava da se nekoliko čipova razmatranih u eksperimentu napravi pogodnim za međusobno poređenje. Osnovni cilj analize u ovoj fazi je da se isključi uticaj sistematskih nebioloških razlika između mikropostrojenja. Izvori takvih razlika su mnogi: varijacije u efikasnosti reverzne transkripcije, označavanje bojom, hibridizacija, fizičke razlike između čipova, male razlike u koncentracijama reagensa i varijacije u laboratorijskim uslovima.
Pokazano je da izbor metode normalizacije ima značajan uticaj na rezultat analize.
Sažimanje
Generalizacija vrijednosti nivoa ekspresije za sve uzorke koji odgovaraju istim sekvencama
Kontrola kvaliteta
Obrada emisije
Glavna faza statističke obrade
Linkovi
- DNK mikromreža
- Eksperiment DNK mikromrežom - članak sa engleske Wikipedije
- Virtualna laboratorija DNK Microarray - interaktivni primjer dvobojnog eksperimenta DNK mikromreža - korak po korak
- Deset zamki mikromrežne analize - uobičajene greške u analizi DNK mikromreža
Specifična sekvenca. Oligonukleotid može biti kratak dio gena ili druge komponente DNK koji se koristi za hibridizaciju sa cDNK ili mRNA. Hibridizacija probe i cilja se detektuje i kvantificira korištenjem fluorescencije ili hemiluminiscencije, omogućavajući da se u uzorku odredi relativna količina nukleinske kiseline date sekvence.
U konvencionalnom DNK mikronipu, sonde su kovalentno pričvršćene za čvrstu površinu - stakleni ili silicijumski čip. Druge platforme, poput onih koje proizvodi Illumina, koriste mikroskopske perle umjesto velikih čvrstih površina. DNK mikronizovi se razlikuju od ostalih mikronizova samo po tome što se koriste za mjerenje DNK ili kao dio složenijeg sistema za detekciju i analizu DNK.
DNK mikronizovi se koriste za analizu promjena u ekspresiji gena, identifikaciju polimorfizama pojedinačnih nukleotida, genotipizaciju ili ponovno sekvenciranje mutantnih genoma. Mikročipovi se razlikuju po dizajnu, radnim karakteristikama, tačnosti, efikasnosti i ceni.
Priča
Bilješke
Wikimedia Foundation. 2010.
Pogledajte šta je "DNK mikročip" u drugim rječnicima:
Pojam DNK mikromrež Pojam na engleskom DNK mikromrež Sinonimi DNK čip, DNK čip, genski čip, DNK čip Skraćenice Vezani pojmovi biosenzor, genom, DNK, DNK sonda, laboratorija na čipu, RNK, oligonukleotid Definicija Minijaturna ploča sa... . ..
Pojam DNK sonda Izraz na engleskom DNK sonda Sinonimi Skraćenice Povezani pojmovi biološki nanoobjekti, biomedicinski mikroelektromehanički sistemi, biosenzor, genom, DNK, DNK mikročip, laboratorija na čipu, oligonukleotid... ... Enciklopedijski rečnik nanotehnologije
Termin DNK Termin na engleskom DNK Sinonimi deoksiribonukleinska kiselina Skraćenice DNK Povezani pojmovi isporuka gena, aktuator, bakteriofag, proteini, biološki nanoobjekti, biomimetika, biomimetički nanomaterijali, genetski inženjering,... ... Enciklopedijski rečnik nanotehnologije
DNK čip
DNK biočip- DNK čip DNK čip (takođe: DNK biočip, DNK mikročip, DNK nanočip) Poseban čip koji se koristi za otkrivanje genetskih mutacija ili pomaka i dijagnosticiranje bolesti. Biočip za američku vojsku, razvijen od strane stručnjaka iz ... ... Objašnjavajući englesko-ruski rječnik o nanotehnologiji. - M.
Mikročip gen m mikromrež- Mikročip, genski čip ili mikročip * mikroniz ili genski čip ili mikročip skup hiljada jedinstvenih poznatih jednolančanih fragmenata DNK imobiliziranih na čvrstoj bazi. Ovi fragmenti predstavljaju sve..... Genetika. enciklopedijski rječnik
Sir Edwin Mallor Southern (rođen 7. juna 1938.) engleski molekularni biolog, član Kraljevskog društva za unapređenje prirodnog znanja (poznatog i kao Londonsko kraljevsko društvo), dobitnik Laskerove nagrade (2005.). Nagrada je bila... Wikipedia
DNK mikroniz koji sadrži komplementarnu DNK. Komplementarna DNK (cDNA) je DNK sintetizirana iz zrele mRNA u reakciji kataliziranoj reverznom transkriptazom. Cha cDNK ... Wikipedia
Kvantitativna analiza nukleinskih kiselina određuje koncentraciju DNK ili RNK u mješavini ili čistom preparatu. Reakcije koje uključuju nukleinske kiseline često zahtijevaju precizne informacije o količini i čistoći lijeka. Odrediti koncentraciju... ... Wikipedia
Pojam amplifikacija Pojam na engleskom jeziku amplification Sinonimi Skraćenice Srodni pojmovi Definicija (latinski amplificatio jačanje, povećanje), u molekularnoj biologiji, povećanje broja kopija DNK. Opis U ćeliji, pojačanje se događa u ... ... Enciklopedijski rečnik nanotehnologije
Ekspresija gena je proces tokom kojeg se nasledna informacija iz gena (sekvenca nukleotida DNK) pretvara u funkcionalni proizvod - RNK ili protein. Regulacija ekspresije gena omogućava stanicama da kontroliraju vlastitu strukturu i funkciju i osnova je stanične diferencijacije, morfogeneze i adaptacije.
DNK čipovi su jedinstveni analitički alat koji vam omogućava da odredite prisustvo specificiranih sekvenci DNK u analiziranom uzorku (obično biološkog porijekla) (tzv. hibridizacijska analiza). Provođenje analize pomoću DNK čipova je nekoliko puta jeftinije od alternativnih tehnologija (elektroforeza, PCR u realnom vremenu) i, uz jednostavan detektor, omogućava rad izvan laboratorija.
Po prvi put DNK čipovi korišćeni su u istraživanju kasnih 1980-ih. Ova danas široko rasprostranjena metoda, koja omogućava istovremenu analizu ekspresije mnogih gena, zasniva se na principu prepoznavanja mRNA ili cDNK meta kroz njihovu hibridizaciju sa jednolančanim DNK fragmentima imobiliziranim na mikročipu. Savremeni DNK mikročip se sastoji od hiljade deoksioligonukleotida (sonda ili uzoraka), grupisanih u obliku mikroskopskih tačaka i fiksiranih na čvrstom nosaču. Svaka tačka sadrži nekoliko pikomola DNK sa specifičnom sekvencom nukleotida. Oligonukleotidi DNK mikromreža mogu biti kratki dijelovi gena ili drugih funkcionalnih DNK elemenata i koriste se za hibridizaciju sa cDNK ili mRNA (cRNA). Hibridizacija probe i cilja se detektuje i kvantificira korištenjem fluorescencije ili hemiluminiscencije, omogućavajući da se u uzorku odredi relativna količina nukleinske kiseline date sekvence.
U konvencionalnom DNK mikronipu, sonde su kovalentno pričvršćene za čvrstu površinu - stakleni ili silicijumski čip. Druge platforme, poput onih koje proizvodi Illumina, koriste mikroskopske perle umjesto velikih čvrstih površina.
DNK mikronizovi se koriste za analizu promjena u ekspresiji gena, identifikaciju polimorfizama pojedinačnih nukleotida, genotipizaciju ili ponovno sekvenciranje mutantnih genoma. Mikročipovi se razlikuju po dizajnu, radnim karakteristikama, tačnosti, efikasnosti i ceni.
DNK mikropostavi:
cDNK mikronizovi
oligonukleotid
(dvobojna sa fluorescentnom detekcijom)
oligonukleotid
(Affymetrix, monokromatski sa fluorescentnom detekcijom)
membranski c-DNK mikronizovi
(sa radioaktivnom detekcijom)
Gel c-DNK čipovi
Proteinski mikročipovi
Malo istorije
1980-e: proteinski čips
~1991: hemija sinteze DNK na supstratu (visoke gustine) - Affymetrix oligonukleotidni čipovi (Fodor, Stryer, Lockhart)
~1995: roboti za mikro iskopavanje – cDNK čipovi Univerziteta Stanford (Pat Brown i Dari Shalon)
1990-te: MPI gel čips
Međutim, još 1982. Augenlicht i Kobrin su predložili DNK niz ( Rak Istraživanja), a 1984. godine napravili su čip koji sadrži 4000 elemenata za proučavanje ćelija raka.
(Članak je odbijen NaukaI Priroda)
Šta se može proučavati korišćenjem DNK mikropostrojenja?
Ekspresija gena u različitim tkivima
Ekspresija gena u normalnim i patološkim stanjima (u normalnim i ćelijama raka)
Promjene u ekspresiji gena tokom vremena kao rezultat vanjskih utjecaja (interakcija stanice sa patogenom, lijekom)
Profili ekspresije(obrasci) razlikuju se između normalnih i ćelija raka ili različitih vrsta raka. Izlječive i neizlječive vrste leukemije proizvode različite obrasce. Na osnovu vrste obrazaca moguće je predvidjeti tok bolesti u vrlo ranoj fazi sa velikom vjerovatnoćom.
Ekspresioni mikročipovi
Jedno od aktivno razvijenih područja korištenjem tehnologije mikromreža je proučavanje transkripcijskih profila kod složenih bolesti. Iako sve stanice u našem tijelu posjeduju istu naslijeđenu genomsku DNK, svaka ćelija izražava različite gene u obliku mRNA prema tipu ćelije, biološkim procesima, normalnom ili patološkom stanju itd. Ova raznolikost u profilima ekspresije gena bila je predmet intenzivnog proučavanja zbog svog biološkog i kliničkog značaja. Sposobnost mikromrežne tehnologije da analizira ekspresiju stotina i hiljada gena pokazala se najtraženijom prilikom dešifriranja tako složene bolesti kao što je rak. Microarray tehnologija omogućava istovremeno praćenje ekspresije desetina hiljada gena, stvarajući molekularni portret ćelije. Najznačajnije implikacije profilisanja genske ekspresije uključuju dijagnozu, stratifikaciju i prognozu kod mnogih karcinoma. Iako je histopatološka procjena, dopunjena citogenetskim pregledom i analizom nekoliko molekularnih markera, još uvijek zlatni standard u postavljanju dijagnoze i određivanju prognoze, nedavni radovi sugeriraju da se u mnogim slučajevima može zamijeniti profiliranjem genske ekspresije. Dijagnoza i prognoza raka zahtijevaju zajedničku ekspertizu nekoliko praktičara, kao što su onkolozi, patolozi i citogenetičari, osim toga, konačni zaključci mogu varirati ovisno o metodološkim pristupima i kvalifikacijama stručnjaka. Mikročipovi bi mogli u potpunosti zamijeniti napore mnogih stručnjaka, osim toga, povećati tačnost u dijagnozi i prognozi, kao i pružiti jedinstvenu standardiziranu platformu za analizu.
Za analizu ekspresije gena koriste se dvije vrste mikromreža: na osnovu komplementarne DNK (cDNK) i na osnovu oligonukleotidnih sondi. Mikronizovi bazirani na cDNK su fragmenti DNK postavljeni na površinu standardnih mikroskopskih naočala ili druge čvrste podloge. U oligonukleotidnim mikronizovima, oligonukleotidi dužine 25-60 nukleotidnih baza (nt) su imobilizirani na istom supstratu. Postupak pripreme uzorka za analizu mikromreža prikazan je na Sl. 2. Ukupna RNK se izoluje iz ćelija (ponekad se izoluje i frakcija mRNA), zatim se izvodi reakcija reverzne transkripcije korišćenjem kombinovanog prajmera koji sadrži sekvencu komplementarnu poliA-terminalnom fragmentu mRNA i region T7 RNA polimeraze promoter. Uključivanje sekvence promotora T7 RNA polimeraze u sintetizovani lanac cDNK omogućava dalje reakcije in vitro amplifikacije: enzim T7 RNA polimeraze proizvodi mnogo kopija RNK iz svakog molekula cDNK u epruveti. Ovako dolazi do linearne amplifikacije originalne mRNA. Po pravilu, dobijeni RNA molekuli se istovremeno obeležavaju upotrebom nukleotida koji sadrže fluorescentnu oznaku u reakciji. U eksperimentima sa oligonukleotidnim mikronizovima, jedan tip fluorescentne oznake se često koristi za označavanje uzorka komplementarne RNK (cRNA), a nivoi ekspresije gena se određuju upoređivanjem rezultirajućih fluorescentnih signala sa onima na internim kontrolnim tačkama mikroniza. Prilikom rada sa mikronizovima baziranim na cDNA, u pravilu se u eksperimentu koriste dva uzorka: kontrolni uzorak se obilježava jednom fluorescentnom bojom, testni uzorak se označava drugom, zatim se miješaju i hibridiziraju s jednim mikročipom. Na osnovu omjera dvije različite fluorescentne oznake u svakoj ćeliji mikročipa, procjenjuje se povećanje ili smanjenje nivoa ekspresije datog gena. Bez obzira na tehnološku platformu, svaki eksperiment generiše podatke koji sadrže procjenu nivoa ekspresije desetina i stotina hiljada gena. Za obradu takve količine podataka koristi se prilično složen matematički aparat, prvenstveno klaster analiza. Podaci mikromreža mogu se analizirati u odnosu na kliničke podatke (analiza vođena hipotezama) ili bez obzira na bilo koju kliničku karakteristiku pacijenta (analiza bez nadzora).
Klasične metode omogućavaju analizu ekspresije nekoliko gena istovremeno ili zahtijevaju korištenje specijaliziranih tehnologija mikromreža, npr. Affymetrix. Affymetrix koristi kombinaciju fotolitografije i kemijske sinteze oligonukleotida za proizvodnju GeneChip® mikronizova.
YELLOW- ako je gen eksprimiran u oboljelom (Cy5) i normalnom (Cy3) tkivu, tada će se DNK označena i crvenom i zelenom bojom hibridizirati na ovom mjestu, što rezultira žutom bojom
RED- ako je gen eksprimiran samo u bolesnom (Cy5) tkivu, tada će se samo DNK označena crvenom bojom hibridizirati na ovom mjestu
ZELENI- ako je gen eksprimiran samo u zdravom (Cy3) tkivu, tada će se na ovom mjestu hibridizirati samo DNK označena zelenom bojom
BLACK– ako gen nije eksprimiran ni u bolesnom ni u zdravom tkivu
dakle,
DNK mikronizovi omogućavaju simultanu analizu informacija o ekspresiji mnogih hiljada gena.
Glavni tipovi DNK mikronizova koji se trenutno koriste su cDNK mikronizovi i oligonukleotidni čipovi iz Affymetrixa.
cDNK mikronizovi bazirani su na hibridizaciji mješovitih eksperimentalnih i kontrolnih uzoraka, označenih različitim fluorescentnim bojama, na čip na čiju površinu je nanesena dvolančana c-DNK, što odgovara ~10.000-20.000 gena.
Affimetrix mikročipovi se baziraju na hibridizaciji biotinom označene cRNA eksperimentalnog uzorka sa setom oligonukleotida Perfect Match i Mismatch sintetiziranih na supstratu čipa, nakon čega slijedi bojenje streptavidin-fikoeritrinom. GeneChip Human Genome U133 Plus 2.0 omogućava istovremenu analizu 47.000 transkripata, uključujući 38.500 karakteriziranih gena. Mikročip uključuje 1.300.000 oligonukleotida različitih tipova.
Analiza dobijenih podataka zahteva višestepenu matematičku obradu korišćenjem posebnih statističkih metoda.
Praktično, upotreba mikročipova danas omogućava rješavanje sljedećih problema:
tačna dijagnoza, identifikacija novih podtipova bolesti, pojašnjenje klasifikacije;
predviđanje tijeka bolesti i kliničkog ishoda, identifikacija gena i signalnih puteva uključenih u patogenezu onkohematoloških bolesti, traženje novih ciljeva za ciljanu diferenciranu terapiju;
razvoj i kreiranje jednostavnijih i jeftinijih dijagnostičkih testova, uključujući i one zasnovane na mikročip tehnologiji (mikročipovi koji sadrže uzorke za desetine ili stotine gena umjesto desetina i stotina hiljada);
uključivanje mikromreža u prospektivna klinička ispitivanja, potvrda rezultata analize mikromreža za uključivanje u protokole kliničkog liječenja, dizajn kliničkih protokola uzimajući u obzir nove podatke o prirodi bolesti dobijenih korištenjem tehnologije mikromreža.
DNK mikronizovi
DNK čipovi su jedinstveni analitički alat koji vam omogućava da odredite prisustvo određenih DNK sekvenci u analiziranom uzorku (obično biološkog porijekla) (tzv. analiza hibridizacije). Provođenje analize pomoću DNK čipova je nekoliko puta jeftinije od alternativnih tehnologija (elektroforeza, PCR u realnom vremenu) i, uz jednostavan detektor, omogućava rad izvan laboratorija.
DNK čipovi su prvi put korišćeni u istraživanjima kasnih 80-ih godina prošlog veka. Ova danas široko rasprostranjena metoda, koja omogućava istovremenu analizu ekspresije mnogih gena, zasniva se na principu prepoznavanja mRNA ili cDNK meta kroz njihovu hibridizaciju sa jednolančanim DNK fragmentima imobiliziranim na mikročipu.
DNK čip je čvrsta podloga na kojoj su imobilizirani jednolančani DNK fragmenti različite dužine (obično kovalentno): kratki - 15-25 nukleotida, dugi - 25-60 nukleotida i cDNK fragmenti - od 100 do 3000 nukleotida. Kao materijali za podlogu koriste se staklo, silicijum, razni polimeri, hidrogelovi (na primjer, na bazi poliakrilamida), pa čak i zlato. Najčešći supstrati su staklo.
Proteinski i peptidni čips
Za analizu proizvoda translacije gena koriste se čipovi izgrađeni na bazi polipeptida. Većina meta lijekova su proteini, stoga proteinski i peptidni čipovi mogu biti korisni za otkrivanje lijekova. Proteinski mikročipovi mogu biti izuzetno korisni u medicini kao minijaturni analitički sistemi za određivanje imunološkog statusa organizma, otkrivanje alergijske senzibilizacije i identifikaciju specifičnih alergena. Mikročipovi, koji predstavljaju kolekciju glavnih antigena glavnih patogenih organizama (bakterija, gljivica i virusa), omogućavaju da se analiziraju uzorci krvi na prisustvo stotina i hiljada antitela istovremeno i brzo identifikuju infekcije. Metode snimanja signala su veliki značaj u razvoju proteinskih mikročipova. To uključuje: prvu poznatu metodu - RIA (radioimunoassay), koja koristi radioaktivnu oznaku, imunotest korištenjem fluorescentnih oznaka - FIA i enzimski imunosorbentni test (ELISA), u kojem je oznaka molekula enzima kovalentno povezana s molekulom antitijela . Visoko aktivni stabilni enzimi (alkalna fosfataza, peroksidaza, itd.) se biraju kao oznake u ELISA testu. Prednost ELISA-e je mogućnost višestrukog pojačanja signala. Poslednjih godina razvijeni su osetljivi sistemi supstrata koji daju nerastvorljive fluorescentne proizvode, kao što je ELF-97. Očigledno, proces proizvodnje proteinskog mikročipa mora uključivati postupak fiksacije i imobilizacije na mikročipu. Izbor metode određen je mnogim parametrima - prirodom početnog supstrata, naknadnim područjem primjene mikročipa itd. Proteinski mikročipovi se aktivno koriste, prije svega, za analizu svih poznatih (i dostupnih) bioloških tekućina, uključujući krvni serum/plazmu, urin, cerebrospinalnu tekućinu, pljuvačku, suznu tekućinu, amnionsku tekućinu itd.